HTA-förordningen
HTA-förordningen ska börja tillämpas i januari 2025. Förordningen syftar till att på EU-nivå samordna utvärdering av medicinsk teknik, det vill säga läkemedel och medicinteknik. Enligt förordningen ska medlemsstaternas HTA-myndigheter bland annat gemensamt utvärdera relativ effekt av nya läkemedel och medicinteknik. Varje medlemsland har sedan en skyldighet att ta hänsyn till rapporterna.
Vad är den nya HTA-förordningen?
I januari 2025 börjar Europaparlamentets och Rådets förordning (EU) 2021/2282 av den 15 december 2021 om utvärdering av medicinsk teknik och om ändring av direktiv 2011/24/EU (HTA-förordningen) att gälla HTA-förordningen antogs i januari 2022 och sedan dess pågår ett intensivt förberedelsearbete på EU-nivå, men även på TLV.
HTA, Health Technology Assessment är det engelska samlingsnamnet på olika vetenskapliga metoder för att utvärdera läkemedel och medicinteknik, främst avseende relativ effekt (det vill säga att effekten av en medicinsk teknik jämfört med annan ny eller befintlig medicinsk teknik). I en bred definition ingår även andra områden som exempelvis hälsoekonomi.
I och med HTA-förordningen kommer kliniska granskningar av ny medicinsk teknik genomföras gemensamt på EU-nivå. Granskningarna kommer att utmynna i rapporter om gemensam klinisk granskning. Tanken är att dessa rapporter ska beaktas i varje lands bedömning om exempelvis pris och subvention.
Om landet tillämpar hälsoekonomiska metoder, som i Sveriges fall, så kommer den hälsoekonomiska bedömningen även fortsättningsvis att göras på nationell nivå.
Begreppet medicinsk teknik omfattar både läkemedel och medicintekniska produkter och det framgår i förordningen vilka produkter i dessa kategorier som kan komma att bli aktuella för gemensamma granskningar.
Genomförandet av förordningen kommer att ske stegvis. I ett första skede omfattas läkemedel för cancersjukdomar samt ATMP, uppskattningsvis 30 produkter per år, och därefter vissa medicintekniska produkter och särläkemedel. Från och med 2030 kommer samtliga läkemedel som genomgår EMA:s regulatoriska process att ingå i processen för gemensamma kliniska granskningar, vilket uppskattas till 120 produkter årligen.
När det gäller medicintekniska produkter kommer det varje år att göras ett urval av vilka produkter som ska vara föremål för gemensamma kliniska granskningar. I förordningen framgår bland annat att de produkter som kan bli aktuella ska ha en hög riskklass och att ett antal urvalskriterier ska beaktas när produkter väljs ut för granskning.
HTA-förordningen omfattar utöver gemensamma kliniska granskningar även gemensam vetenskaplig rådgivning, identifiering av ny medicinsk teknik samt möjlighet till frivilligt samarbete.
Vad innebär förordningen för TLV:s arbete?
Medlemsländerna ska i sina nationella HTA-processer beakta de rapporter om gemensam klinisk granskning (benämns JCA-rapporter av begreppet Joint Clinical Assessments) som tas fram inom ramen för HTA-förordningen. TLV:s utredningar inför beslut om pris och subvention om nya läkemedel samt TLV:s hälsoekonomiska bedömningar av klinikläkemedel och medicintekniska produkter är exempel på sådana nationella HTA-processer som avses.
Ett av syftena med HTA-förordningen är att varje medlemsland i hög grad ska kunna använda sig av gemensamma utredningar som görs på europeisk nivå. I vilken utsträckning denna förhoppning kommer att infrias är beroende av hur väl de EU-gemensamma processerna kan samspela med de processer som i dag finns på nationell nivå.
Hur förbereder sig TLV för att i framtiden kunna jobba i enlighet med förordningen?
TLV arbetar med att förbereda för ett deltagande i gemensamma europeiska utvärderingar av läkemedel och medicinteknik i enlighet med HTA-förordningen. Förberedelserna sker dels på nationell nivå, dels genom deltagande i förberedelsearbete på EU-nivå. Vi har även en löpande dialog med andra svenska aktörer som på olika sätt berörs av förordningen, såsom SBU, Läkemedelsverket och regionerna.
I vilken utsträckning TLV ska kunna dra nytta av de gemensamma utredningarna, och inte behöva upprepa samma utredningsmoment, är beroende av hur väl de EU-gemensamma processerna kan samspela med de nuvarande svenska processerna. De delar som omfattas av de gemensamma kliniska granskningarna är dock en relativt begränsad del av det utredningsarbete som behövs för att myndigheten ska kunna fatta beslutom nya läkemedel inom läkemedelsförmånen.
En central del i det nationella förberedelsearbetet är därför att anpassa de nationella ärendehandläggningsprocesserna till processerna på EU-nivå. Detta görs bland annat genom att kartlägga nuvarande processer, analysera behov av förändringar utifrån kraven i förordningen, samt utvecklar förslag på genomförande av denna omställning.
När förordningen börjar tillämpas kommer även nya arbetsmoment att krävas. Exempel på detta är att TLV i ett tidigt stadie snabbt behöver ta fram nationella granskningsomfattningar (så kallade PICO) inför utvärderingarna på EU-nivå.
Det kommer att göras för samtliga produkter som går genom EMA:s processer, vilket är betydligt fler produkter än vad myndigheten utvärderar idag. Ett internt arbete pågår med att ta fram ett förslag på organisation och arbetssätt som möjliggör detta. Bland annat kommer det att finnas behov av utlåtanden från kliniska experter, vilket kräver en utvecklad samverkan med regionerna. TLV och SBU, som medlemmar i arbetsgruppen för gemensamma kliniska granskningar (läs mer i nästa avsnitt), kommer behöva samverka vid framtagandet av den svenska granskningsomfattningen.
Hur är det europeiska samarbetet organiserat och på vilket sätt deltar TLV i det?
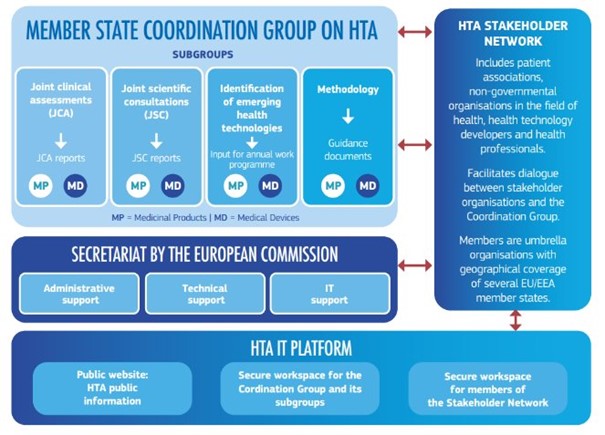
Förberedelsearbetet på EU-nivå sker inom HTA-förordningens samordningsgrupp (Coordination Group) och dess fyra olika arbetsgrupper (subgroups) som utgörs av medlemsländernas HTA-organisationer och andra berörda aktörer.
TLV och SBU är Sveriges medlemmar i samordningsgruppen. TLV deltar även i samtliga fyra arbetsgrupper och SBU deltar i två av arbetsgrupperna. Som medlemmar i grupperna bidrar vi i framtagning av de metoddokument och riktlinjer som ska komma på plats inför 2025. Arbetet i samordningsgruppen leds av den ordförande och två vice-ordföranden som samordningsgruppen utsåg i slutet av 2022, tillsammans med ordförande och vice ordförande i de fyra arbetsgrupperna. TLV:s chefsfarmaceut Niklas Hedberg är vice ordförande i samordningsgruppen med särskild sakkunskap om läkemedel.
Utöver samordningsgruppen och dess arbetsgrupper finns en genomförandekommitté för HTA-förordningen som bistår kommissionen vid framtagandet av de genomförandeakter som kommer att behövas när lagstiftningen ska genomföras från och med januari 2025. Genomförandeakter antas av kommissionen och anger mer detaljerade bestämmelser för på vilket sätt som bindande EU-rättsakter ska genomföras. I genomförandekommittén för HTA-förordningen finns representanter från TLV och SBU.
Den Europeiska kommissionen utgör sekretariat för arbetet inom HTA-förordningen och bidrar med administrativ och teknisk support. Bilden visar kommissionens visualisering av styrningen av HTA-förordningen. Utöver samordningsgruppen och kommissionen finns ett nätverk för berörda parter (Stakeholder Network) som samlar intressenter i form av patientorganisationer, professionsorganisationer och branschorganisationer. Nätverket ska användas för att möjliggöra dialog mellan berörda parter och samordningsgruppen. Allt arbete under HTA-förordningen kommer att samlas på en gemensamt IT-plattform.
Var hittar jag mer information?
Mer information om HTA-förordningen och nyheter om hur arbetet på EU-nivå fortskrider finns på en särskild del av kommissionens hemsida.
https://health.ec.europa.eu/health-technology-assessment_en Länk till annan webbplats.
Länk till annan webbplats.
På kommisionens sida publiceras löpande information om exempelvis:
- Stöddokument, mallar, genomförandeakter som antagits av kommissionen eller samordningsgruppen
- Dokument som publiceras för inhämtande av synpunkter från allmänheten
- från möten med samordningsgruppen
- Godkända mötesanteckningar från möten med samordningsgruppen
- Kalendarium för möten med samordningsgruppen och dess arbetsgrupper
Sidinformation
- Senast uppdaterad
- 8 juli 2024